La mixomatosis es una enfermedad causada por el virus del mixoma , un poxvirus del género Leporipoxvirus . Los huéspedes naturales son los tapeti ( Sylvilagus brasiliensis ) en América del Sur y Central, y los conejos matorraleros ( Sylvilagus bachmani ) en América del Norte. El virus del mixoma causa sólo una enfermedad leve en estas especies, pero causa una enfermedad grave y generalmente mortal en los conejos europeos ( Oryctolagus cuniculus ).
La mixomatosis es un ejemplo de lo que ocurre cuando un virus salta de una especie adaptada al virus a un huésped ingenuo, y ha sido ampliamente estudiada por este motivo. [1] El virus fue introducido intencionalmente en Australia, Francia y Chile en la década de 1950 para controlar las poblaciones de conejos europeos salvajes. [2] [3]

El virus mixoma pertenece al género Leporipoxvirus (familia Poxviridae ; subfamilia Chordopoxvirinae ). Al igual que otros poxvirus, los virus mixoma son virus de ADN grandes con ADN bicatenario lineal. La replicación del virus ocurre en el citoplasma de la célula. Los huéspedes naturales son los tapeti ( Sylvilagus brasiliensis ) en América del Sur y Central, y los conejos matorraleros ( Sylvilagus bachmani ) en América del Norte. El virus mixoma causa solo una enfermedad leve en estas especies, con signos limitados a la formación de nódulos en la piel. [4]
Mixomatosis es el nombre de la enfermedad grave y a menudo mortal que afecta a los conejos europeos causada por el virus del mixoma. Existen diferentes cepas que varían en su virulencia. La cepa californiana, que es endémica de la costa oeste de los Estados Unidos y de Baja California en México, es la más virulenta, con tasas de letalidad notificadas del 100%. La cepa sudamericana, presente en América del Sur y América Central, es ligeramente menos virulenta, con tasas de letalidad notificadas del 99,8%. Las cepas presentes en Europa y Australia se han atenuado, con tasas de letalidad notificadas del 50 al 95%. Si bien los conejos salvajes de Europa y Australia han desarrollado cierta inmunidad al virus, esto no suele ser así en el caso de los conejos domésticos. [5]
La mixomatosis se transmite principalmente por insectos. La transmisión de la enfermedad ocurre comúnmente a través de picaduras de mosquitos [ ¿cuáles? ] o pulgas, pero también puede ocurrir a través de picaduras de moscas y piojos, así como de ácaros arácnidos . El virus de la mixomatosis no se replica en estos huéspedes artrópodos, sino que es transportado físicamente por artrópodos que pican de un conejo a otro. La estacionalidad está determinada por la disponibilidad de vectores artrópodos y la proximidad de conejos salvajes infectados. [6]
El virus del mixoma también puede transmitirse por contacto directo. Los conejos infectados excretan el virus en las secreciones oculares y nasales y en las zonas de piel erosionada. El virus también puede estar presente en el semen y las secreciones genitales. Los poxvirus son bastante estables en el medio ambiente y pueden propagarse a través de objetos contaminados, como botellas de agua, comederos, jaulas o las manos de las personas. [6] Son resistentes a la desecación, pero sensibles a algunos desinfectantes. [7]
Un estudio de laboratorio en el que conejos europeos recibieron inyecciones intradérmicas de una cepa sudamericana del virus del mixoma demostró la siguiente progresión de la enfermedad. Inicialmente, el virus se multiplicó en la piel en el lugar de la inoculación. Aproximadamente dos días después de la inoculación, el virus se encontró en los ganglios linfáticos cercanos y a los tres días se encontró en el torrente sanguíneo y los órganos abdominales. Aproximadamente a los cuatro días, el virus se aisló de la piel no inoculada, así como de los testículos. El quinto día se detectó un ligero engrosamiento de los párpados y la presencia del virus en el líquido conjuntival. Se observó congestión testicular el sexto día. [8]
.jpg/440px-Rabbit_with_Myxomatosis_1(RLH).jpg)

Los signos clínicos de la mixomatosis dependen de la cepa del virus, la vía de inoculación y el estado inmunológico del huésped. Los signos de la forma nodular clásica de la enfermedad incluyen una masa subcutánea en el sitio de inoculación, hinchazón y edema de los párpados y los genitales, secreción ocular lechosa o purulenta, fiebre, letargo, depresión y anorexia. [6]
Según Meredith (2013), la evolución temporal típica de la enfermedad es la siguiente: [4]
En caso de enfermedad hiperaguda con una cepa muy virulenta, la muerte puede ocurrir dentro de los 5 a 6 días posteriores a la infección, con signos clínicos mínimos aparte de la conjuntivitis . La muerte suele ocurrir entre los días 10 y 12. Las cepas muy virulentas, como las presentes en América del Norte y del Sur, tienen tasas de letalidad de casi el 100%.
En los conejos infectados con cepas atenuadas y menos virulentas del virus, las lesiones que se observan son más variables y, en general, más leves, y su evolución se retrasa y se prolonga. Muchos conejos sobreviven y las lesiones cutáneas gradualmente forman costras y se caen, dejando cicatrices. También se observa una forma más leve de la enfermedad en conejos domésticos vacunados previamente que tienen inmunidad parcial. Los conejos vacunados a menudo presentan lesiones costrosas localizadas, con frecuencia en el puente de la nariz y alrededor de los ojos, o múltiples masas cutáneas en todo el cuerpo. A menudo, todavía están brillantes y alertas, y sobreviven con los cuidados de enfermería. [4]
Los signos respiratorios son un hallazgo común en los conejos que sobreviven a las primeras etapas de la mixomatosis. Se produce secreción nasal mucopurulenta, que provoca respiración jadeante y estertorosa con extensión de la cabeza y el cuello. En muchos casos se produce neumonía bacteriana secundaria . La enfermedad respiratoria crónica, como la secreción nasal, es común en los conejos supervivientes. Incluso en conejos aparentemente recuperados, no es raro encontrar lóbulos pulmonares llenos de líquido en lugar de aire en la necropsia . [6]
Desde la década de 1970 se ha descrito en Europa una forma "amixomatosa" de la enfermedad que carece de los nódulos cutáneos típicos de la mixomatosis. Esta forma es clínicamente más leve y generalmente no letal. Predominan los signos respiratorios, incluida la secreción nasal clara o purulenta . En general, todavía están presentes el edema perineal, los párpados hinchados y la blefaroconjuntivitis purulenta . Esta forma se ha observado en conejos salvajes, pero es significativa principalmente en conejos de granja. [4]
El diagnóstico de mixomatosis en conejos europeos se hace a menudo sobre la base de la apariencia clínica característica. Si un conejo muere sin mostrar los signos clásicos de mixomatosis, o si se desea una confirmación adicional, hay una serie de pruebas de laboratorio disponibles. Históricamente, estas han incluido histopatología , microscopía electrónica y aislamiento del virus . El examen histopatológico de la piel afectada generalmente muestra células mesenquimales indiferenciadas dentro de una matriz de mucina , células inflamatorias y edema . Se pueden ver inclusiones intracitoplasmáticas en la epidermis y en el epitelio conjuntival. [9]
El examen con microscopio electrónico con tinción negativa también se puede utilizar para el diagnóstico debido al gran tamaño y la estructura distintiva de los poxvirus. Este método permite la visualización rápida de los poxvirus, pero no permite la verificación específica de las especies o variantes del virus. [10] El aislamiento del virus sigue siendo el "patrón oro" con el que se comparan otros métodos de detección de virus. Al menos en teoría, un solo virus viable presente en una muestra se puede cultivar en células cultivadas, expandiéndolo así para producir suficiente material para permitir una caracterización más detallada. [11]
El desarrollo más reciente de métodos moleculares como la reacción en cadena de la polimerasa (PCR) y los ensayos de reacción en cadena de la polimerasa en tiempo real han creado métodos más rápidos y precisos para la identificación del virus del mixoma. [10] La PCR en tiempo real simplifica el diagnóstico de la mixomatosis al permitir que se analicen rápidamente muestras nasales, oculares o genitales. También se puede utilizar en muestras de tejido embebidas en parafina para confirmar la presencia del virus del mixoma e identificar la cepa viral. [12]
En la actualidad, no existe un tratamiento específico para la mixomatosis. Si se decide intentar el tratamiento, es necesario un seguimiento cuidadoso para evitar prolongar el sufrimiento. Los conejos vacunados previamente o los infectados con una cepa atenuada pueden recuperarse si se les administran líquidos, alimentos y antivirales de amplio espectro. La interrupción de la ingesta de alimentos y agua, la pérdida de peso grave continua o una temperatura rectal inferior a 37 °C (98,6 °F) son razones para considerar la eutanasia. [6]
En algunos países existen vacunas contra la mixomatosis. Todas son vacunas vivas modificadas basadas en cepas atenuadas del virus del mixoma o en el virus del fibroma de Shope, estrechamente relacionado con el mismo, que proporciona inmunidad cruzada. Se recomienda que todos los conejos de las zonas del mundo donde la mixomatosis es endémica sean vacunados de forma rutinaria, incluso si se mantienen en el interior, debido a la capacidad del virus de ser transportado al interior por vectores o fómites . En situaciones de grupo en las que los conejos no son vacunados de forma rutinaria, la vacunación ante un brote es beneficiosa para limitar la morbilidad y la mortalidad. [4] La vacuna no proporciona una protección del 100%, [6] por lo que sigue siendo importante prevenir el contacto con conejos salvajes e insectos vectores. Las vacunas contra la mixomatosis deben ser reforzadas periódicamente para que sigan siendo eficaces, y normalmente se recomiendan vacunaciones anuales. [4]
En Europa y el Reino Unido se encuentra disponible una vacuna bivalente vectorizada denominada Nobivac Myxo-RHD [13] que protege contra la mixomatosis y la enfermedad hemorrágica del conejo . Esta vacuna está autorizada para la inmunización de conejos de 5 semanas de edad o más, y la aparición de la inmunidad demora aproximadamente 3 semanas. La protección contra la mixomatosis y la enfermedad hemorrágica del conejo tiene una duración de inmunidad de 12 meses, y se recomienda la vacunación anual para garantizar una protección continua. Se ha demostrado que la vacuna reduce la mortalidad y los signos clínicos de la mixomatosis. [14]
Actualmente, la vacunación contra la mixomatosis está prohibida en Australia debido a la preocupación de que el virus de la vacuna pueda propagarse a los conejos salvajes y aumentar su inmunidad a la mixomatosis. Como los conejos salvajes en Australia ya causan un gran daño ambiental, el gobierno se toma en serio esta preocupación. [15] Muchos conejos domésticos en Australia siguen muriendo de mixomatosis debido a su falta de inmunidad. [16] Hay al menos una campaña para permitir la vacuna para las mascotas domésticas. [17] La Asociación Veterinaria Australiana apoya la introducción de una vacuna segura y eficaz contra la mixomatosis para los conejos domésticos, [18] y la RSPCA de Australia ha pedido repetidamente una revisión de las vacunas contra el virus del mixoma disponibles y una evaluación científica de sus posibles impactos en el entorno australiano. [19]
Aunque la mixomatosis es endémica en algunas partes de México y Estados Unidos, no existe una vacuna disponible comercialmente en ninguno de estos países. La información sobre casos notificados recientemente en Estados Unidos está disponible en la House Rabbit Society. [20] En Estados Unidos, la importación de vacunas está supervisada por el Servicio de Inspección de Sanidad Animal y Vegetal, parte del Departamento de Agricultura. [21]
En lugares donde la mixomatosis es endémica pero no hay vacunas disponibles, es de vital importancia prevenir la exposición al virus del mixoma. Incluso los conejos vacunados necesitan protección, ya que las vacunas no son 100% efectivas. El riesgo de que una mascota contraiga mixomatosis se puede reducir evitando el contacto con conejos salvajes, manteniéndolos dentro de casa (preferiblemente) o detrás de mosquiteros para evitar la exposición a mosquitos y usando medicamentos seguros para conejos para tratar y prevenir pulgas, piojos y ácaros. Cualquier conejo nuevo que pueda haber estado expuesto debe ser puesto en cuarentena, y los conejos sospechosos de tener mixomatosis deben ser aislados inmediatamente hasta que se descarte el diagnóstico. Si se confirma la enfermedad, todas las jaulas, platos u otros objetos contaminados deben desinfectarse con lejía al 10%, hidróxido de sodio al 10% o formalina al 1%–1,4%. [22]

El virus de la mixomatosis fue el primer virus introducido intencionalmente en la naturaleza con el propósito de erradicar una plaga de vertebrados, concretamente el conejo europeo en Australia y Europa. El fracaso a largo plazo de esta estrategia se ha debido a las presiones selectivas naturales tanto sobre las poblaciones de conejos como sobre las del virus, lo que dio lugar a la aparición de animales resistentes a la mixomatosis y variantes atenuadas del virus. El proceso se considera un ejemplo clásico de coevolución huésped-patógeno tras la transmisión entre especies de un patógeno. [23]


Los conejos europeos llegaron a Australia en 1788 gracias a los primeros colonos ingleses. Al principio se utilizaban como fuente de alimento, pero más tarde se volvieron salvajes y su número se disparó. En noviembre de 1937, el Consejo Australiano de Investigación Científica e Industrial utilizó la isla Wardang para realizar sus primeros ensayos de campo de mixomatosis, que establecieron la metodología para la liberación exitosa del virus del mixoma en todo el país. [24]
En 1950, la cepa SLS del virus mixoma del tapeti sudamericano ( Sylvilagus brasiliensis ) fue liberada en Australia como agente de control biológico contra los conejos salvajes. El virus fue al principio altamente letal, con una tasa de letalidad estimada cercana al 99,8%. Sin embargo, en pocos años esta cepa fue reemplazada por otras menos virulentas, lo que permitió una mayor supervivencia de los conejos infectados y mejoró la transmisión de la enfermedad. El virus creó una fuerte presión selectiva para la evolución de conejos resistentes a la mixomatosis. A medida que los conejos se volvieron más resistentes, las cepas virales respondieron volviéndose menos virulentas. [5] El virus de la enfermedad hemorrágica del conejo también se ha utilizado para controlar las poblaciones de conejos salvajes en Australia desde 1995. [25]
En junio de 1952, Paul-Félix Armand-Delille , propietario de una finca en el noroeste de Francia, inoculó a dos conejos salvajes la cepa Lausana del virus del mixoma. [26] Su intención era solo erradicar los conejos en su propiedad y ciudad, pero la enfermedad se extendió rápidamente por Europa occidental, Irlanda y el Reino Unido. [2] Algunas diseminaciones del virus parecían claramente deliberadas, como la introducción en Gran Bretaña en 1953 y la introducción en Irlanda en 1954. [27] Sin embargo, a diferencia de lo que ocurrió en Australia, se hicieron grandes esfuerzos para detener la propagación en Europa. Estos esfuerzos resultaron en vano. Según las estimaciones, la población de conejos salvajes en el Reino Unido se redujo en un 99%, en Francia entre un 90% y un 95% y en España un 95%. Esto, a su vez, llevó a los depredadores especializados en conejos, como el lince ibérico y el águila imperial española , al borde de la extinción. [28] [29]
La mixomatosis no sólo redujo la población de conejos silvestres y la población de sus depredadores naturales, sino que también tuvo un impacto significativo en la gran industria cunícola, que producía conejos domésticos para carne y pieles. [30] La cepa de Lausana del virus mixoma causa la formación de grandes nódulos morados en la piel, un signo que no se observa en otras cepas. Como sucedió en Australia, el virus se ha vuelto generalmente menos virulento y las poblaciones de conejos silvestres más resistentes posteriormente. [2]
La introducción de la mixomatosis en Nueva Zelanda en 1952 para controlar un creciente problema de los conejos fracasó por falta de un vector. [31]
En 1936, dos parejas de conejos europeos liberados en Punta Santa María provocaron una infestación que se extendió por la mitad norte de Tierra del Fuego . En 1950, la Armada Argentina y un criador privado de conejos introdujeron más conejos cerca de Ushuaia . Los conejos se convirtieron rápidamente en plagas, llenando el suelo de agujeros y dejándolo sin pasto. En 1953, la población de conejos ascendía a unos 30 millones. En 1954, las autoridades chilenas introdujeron una cepa brasileña del virus mixoma en Tierra del Fuego, que logró reducir la población de conejos a niveles muy bajos. [32]
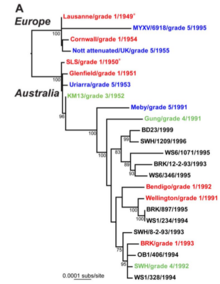
Dada la importancia de la evolución viral para la aparición de enfermedades, la patogénesis , la resistencia a los fármacos y la eficacia de las vacunas, ha sido bien estudiada por teóricos y experimentadores. Las introducciones del virus del mixoma en poblaciones de conejos europeos en Australia y Francia crearon experimentos naturales en la evolución de la virulencia. [33] Si bien las cepas virales iniciales eran altamente virulentas, pronto se recuperaron cepas atenuadas del campo. Estas cepas atenuadas, que permitieron que los conejos sobrevivieran más tiempo, llegaron a dominar porque se transmitían más fácilmente. A medida que se publicaron las secuencias completas del genoma de múltiples cepas de mixoma, los científicos pudieron identificar exactamente qué genes son responsables de los cambios en la virulencia y el comportamiento del virus del mixoma. [34]
Sin embargo, la evolución de la enfermedad ha resultado ser cada vez más compleja e impredecible, tanto entre las distintas cepas del huésped como entre las cepas del virus. Tanto en los modos de resistencia como de virulencia, y en todos los países en los que se ha introducido el virus para el control de los conejos salvajes, los huéspedes y los patógenos se han adaptado continuamente de diversas maneras a los desafíos evolutivos. Aunque las cepas actuales de mixomatosis no proporcionan un control suficiente por sí solas, la enfermedad sigue siendo un factor ecológico significativo en el control de los conejos, tanto en Australia como en otros países. Por ejemplo, a pesar de la preocupación a largo plazo en Australia especialmente, donde la virulencia inicial de la mixomatosis disminuyó después de unas décadas en el campo, la evolución de la resistencia de los conejos a la enfermedad no ha quedado sin cuestionamientos. En el caso de algunas cepas recientes del virus, por ejemplo, la selección para una inflamación reducida prolonga la replicación del virus, lo que mejora la transmisión y reduce la supresión del virus por la fiebre del huésped; también puede causar inmunosupresión, lo que favorece una alta virulencia. [35] Los estudios continúan, tanto en el contexto del control del conejo como de los principios evolutivos relevantes.
Los conejos protagonistas de la novela Watership Down (1972) de Richard Adams se refieren a la mixomatosis como "la ceguera blanca" , y en la historia un jefe conejo había expulsado a todos los conejos que parecían estar afectados. En uno de los cuentos populares de la novela sobre el héroe conejo El-ahrairah, el señor del inframundo de los conejos, el Conejo Negro de Inle, le explica la transmisión de la enfermedad ("la transmiten las pulgas en las orejas de los conejos; pasan de las orejas de un conejo enfermo a las de sus compañeros"). [36]
El sexto álbum de la banda británica Radiohead , Hail to the Thief , contiene una canción llamada "Mixomatosis". La enfermedad se utiliza como analogía de la atención periodística que recibe la banda. Thom Yorke ha dicho:
"Recuerdo que mis padres me señalaban todos esos conejos muertos en la calle cuando yo era niño. No sabía mucho sobre el virus, ni siquiera cómo se escribía, pero me encantaba la palabra. Me encantaba cómo sonaba". [37]
La mixomatosis (una enfermedad viral de los conejos, causada por el virus del mixoma) se había introducido en Nueva Zelanda en 1952, pero no logró establecerse porque no había un vector que la propagara entre la población de conejos.